6月6日,蘇州工業(yè)園區(qū)企業(yè)海邁醫(yī)療科技(蘇州)有限公司傳來喜訊,公司旗下首個國產(chǎn)生物型人工血管LineMatrix耐邁通?FIM臨床試驗(yàn)在浙江大學(xué)醫(yī)學(xué)院附屬邵逸夫醫(yī)院腎內(nèi)科與血液凈化中心圓滿完成隨訪。
臨床隨訪結(jié)果顯示,產(chǎn)品完成植入后,患者術(shù)后3月初級通暢率90.9%,累積通暢率100%;術(shù)后6月初級通暢率80.8%,累積通暢率100%。人工血管未引發(fā)人體免疫反應(yīng),無感染及動脈瘤等并發(fā)癥發(fā)生,產(chǎn)品性能明顯優(yōu)于ePTFE人工血管,臨床效果優(yōu)異。
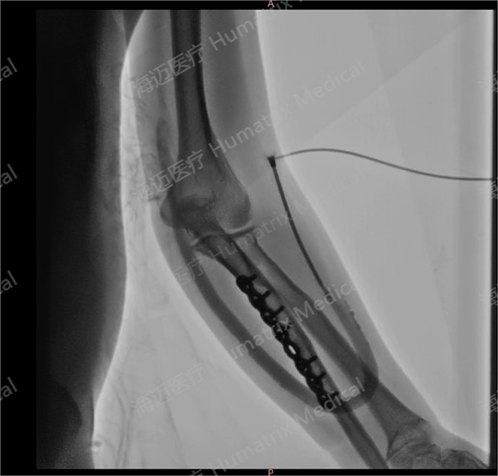
臨床試驗(yàn)患者使用LineMatrix耐邁通?生物型人工血管長期血液透析,血管造影通暢。
此次臨床試驗(yàn)由浙江大學(xué)醫(yī)學(xué)院附屬邵逸夫醫(yī)院腎內(nèi)科與血液透析中心主任李華擔(dān)任主要研究者。產(chǎn)品于2024年9月24日首例植入,并于2025年6月5日完成所有入組患者臨床隨訪。在李華看來,LineMatrix耐邁通?生物型人工血管用于建立終末期腎臟病患者移植物動靜脈內(nèi)瘺臨床效果優(yōu)異。所有患者均使用植入人工血管進(jìn)行血液透析,初步證實(shí)LineMatrix耐邁通?生物型人工血管在人體內(nèi)的安全性和有效性。“傳統(tǒng)ePTFE人工血管6月初級通暢率最高不超過50-60%。LineMatrix耐邁通?生物型人工血管通暢率高,使用后可顯著減少患者術(shù)后干預(yù)次數(shù),節(jié)省醫(yī)保資金并極大減輕患者經(jīng)濟(jì)負(fù)擔(dān),為血管通路建立提供國產(chǎn)新方案,有望逐步替代傳統(tǒng)ePTFE人工血管,惠及廣大患者。”
海邁醫(yī)療科技(蘇州)有限公司創(chuàng)始人邱雪峰表示,自來到蘇州工業(yè)園區(qū)創(chuàng)業(yè)以來,公司初創(chuàng)團(tuán)隊(duì)在3年內(nèi)完成首個國產(chǎn)生物型人工血管臨床試驗(yàn),離不開園區(qū)、BioBAY等給予的大力支持。基于FIM研究優(yōu)異臨床結(jié)果,公司即將啟動LineMatrix耐邁通?生物型人工血管全國多中心產(chǎn)品注冊臨床試驗(yàn),快速推進(jìn)“國產(chǎn)首個”生物型人工血管上市,實(shí)現(xiàn)下一代性能更優(yōu)異人工血管的國產(chǎn)化替代。同時,公司還在開發(fā)全球First-in-class的3.5mm內(nèi)徑人工血管,已在羊心臟原位搭橋模型取得了突破性進(jìn)展,將實(shí)現(xiàn)冠心病冠脈搭橋術(shù)50年以來手術(shù)方式及手術(shù)療效的顛覆性變革。
海邁醫(yī)療成立于2021年,是一家臨床階段的組織工程與再生醫(yī)學(xué)平臺技術(shù)公司,為國內(nèi)唯一、全球第二家具備量產(chǎn)小口徑(內(nèi)徑≤6mm)組織工程血管能力的企業(yè)。公司專注于標(biāo)準(zhǔn)化大規(guī)模培養(yǎng)和生產(chǎn)小口徑組織工程血管,產(chǎn)品適應(yīng)證包括慢性腎透析血管通路建立、下肢動脈外傷(包括戰(zhàn)場血管損傷)血管替代、下肢動脈粥樣硬化及冠狀動脈搭橋術(shù),在此技術(shù)平臺上研發(fā)、生產(chǎn)其他再生醫(yī)學(xué)產(chǎn)品,并擴(kuò)大至全球范圍的臨床研究及商業(yè)化。去年5月,公司建成2243平方米的C+A級別GMP生產(chǎn)車間及質(zhì)檢中心并投入使用,年產(chǎn)量超過3萬根。
編輯 嚴(yán)春霞
2025年6月6日










